Progression der Geographischen Atrophie
Atrophieregionen beginnen typischerweise außerhalb der Fovea und dehnen sich bis in die Fovea aus, was im Laufe der Zeit zu einem dauerhaften Verlust des Sehvermögens führt.1
Derzeit sind weltweit mehr als 5 Millionen Menschen von Geographischer Atrophie betroffen. Es wird erwartet, dass diese Zahl bis 2040 auf mehr als 18 Millionen ansteigen wird.1
Ab einem Alter von 50 Jahren vervierfacht sich die Prävalenz alle 10 Jahre.6
Die Geographische Atrophie macht
bis zu 20% aller rechtssicheren Erblindungen aus, die auf AMD zurückzuführen sind.7,8
Ein Auge mit Geographischer Atrophie kann natürlich auch eine feuchte AMD entwickeln und umgekehrt.9
der Patienten mit feuchter AMD entwickelten über eine durchschnittliche Nachbeobachtungszeit von 7,3 Jahren eine geografischen Atrophie.10
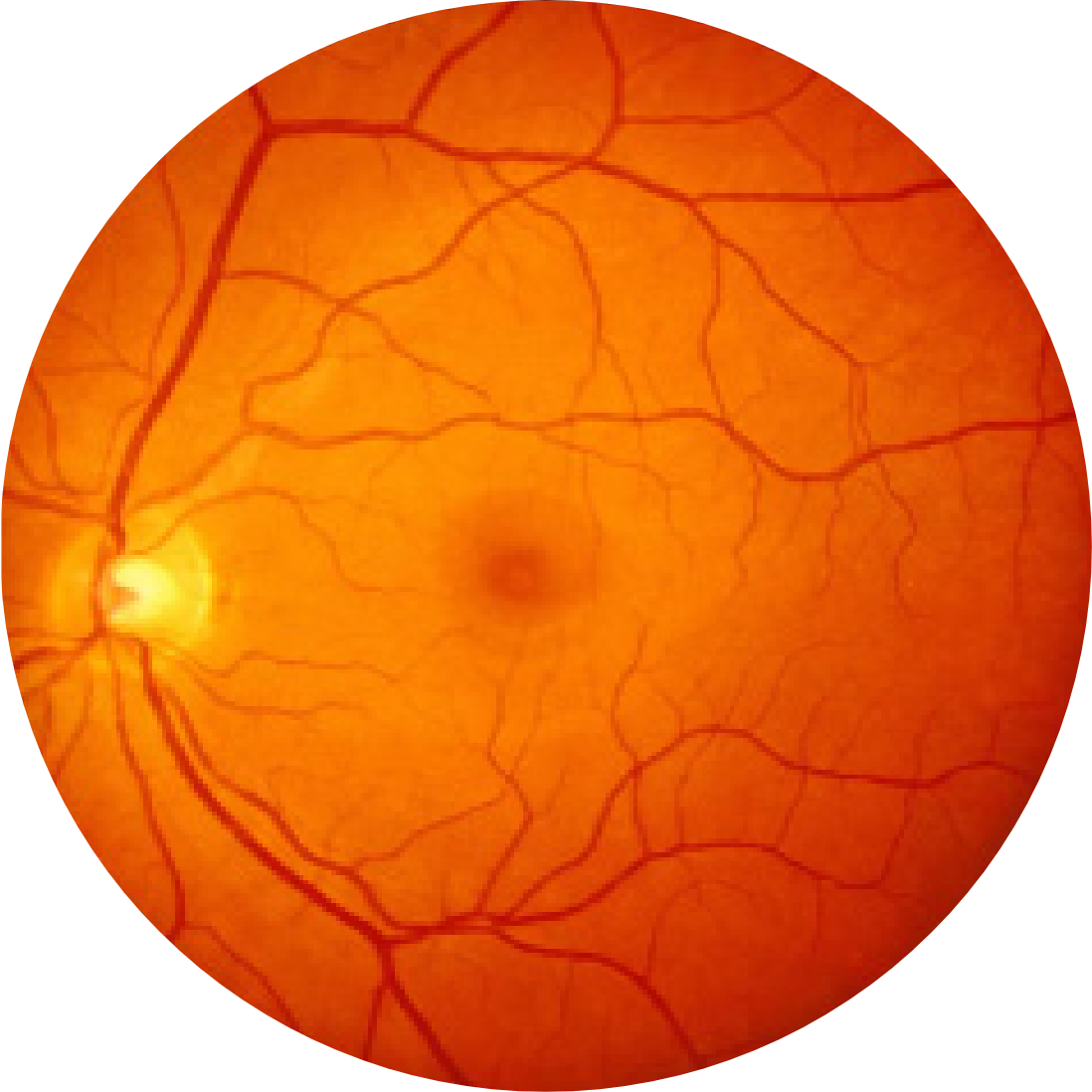
Fundusfotografie eines gesunden Auges
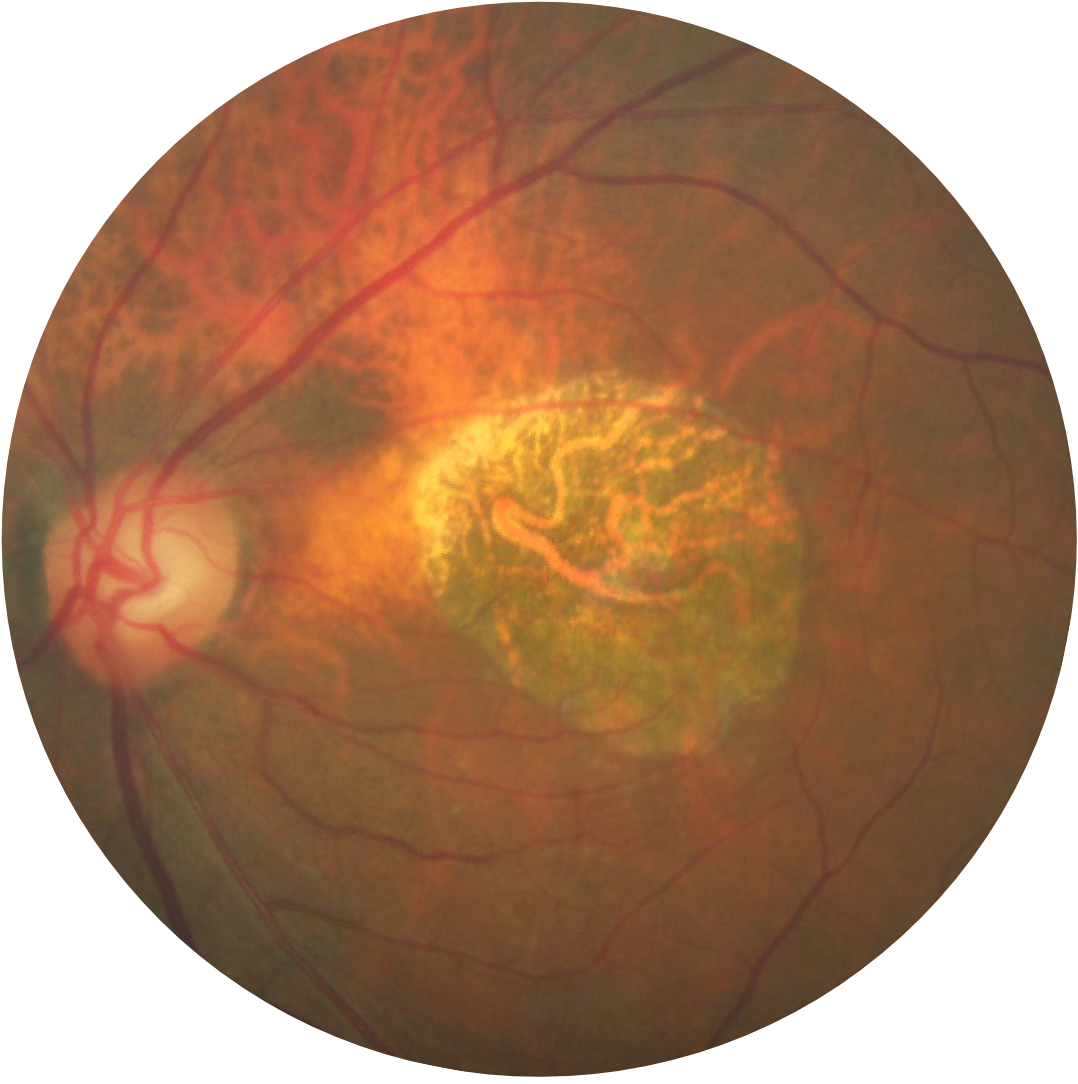
Fundusfotografie eines Auges mit Geographischer Atrophie
Die Geographische Atrophie ist durch einen progressiven und irreversiblen Verlust der Photorezeptoren, des retinalen Pigmentepithels (RPE) und der darunterliegenden Choriokapillaris gekennzeichnet.1,2
Atrophieregionen beginnen typischerweise außerhalb der Fovea und dehnen sich bis in die Fovea aus, was im Laufe der Zeit zu einem dauerhaften Verlust des Sehvermögens führt.1
Ursachen der Geographischen Atrophie
Die altersabhängige Makuladegeneration ist eine komplexe, multifaktorielle Erkrankung und die Geographische Atrophie-Pathogenese umfasst eine komplexe Interaktion von genetischen, physiologischen und Umweltfaktoren.11-14
Genetik
- Drusenbildung
- Bildung reaktiver Sauerstoffspezies
- Entzündung
- Immunantwort, einschließlich Komplement
Physiologie
- Alter ist der größte Risikofaktor für Geographische Atrophie
- Bestimmte Arten von Dyslipidämien
Umgebung
- Sonnenlicht, Rauchen und Ernährung
- Hoher Alkoholkonsum
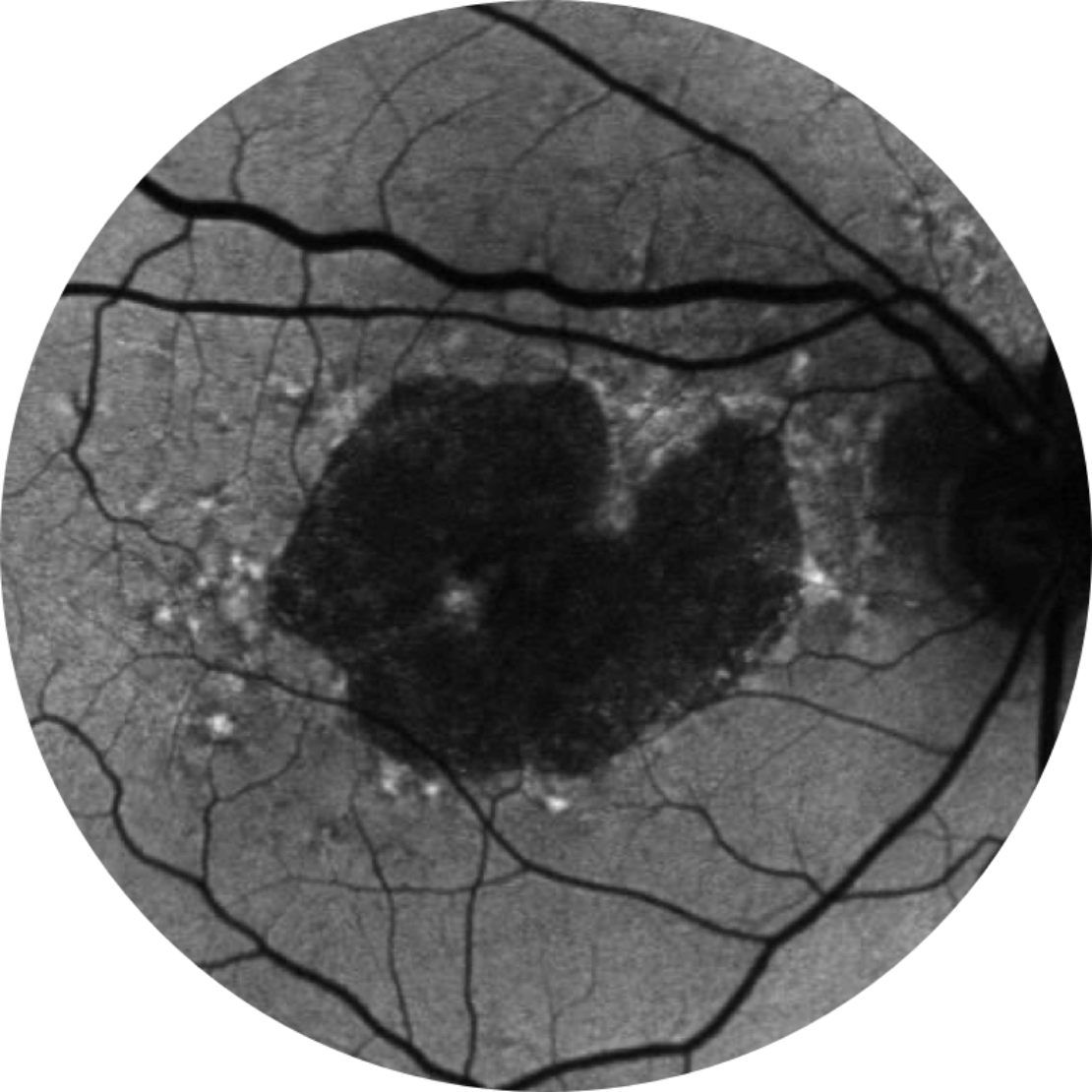
Baseline Jahr 1
BCVA 20/63+, GA-Fläche 5,18 mm2
Baseline Jahr 2
BCVA 20/80-2, GA-Fläche 10,39 mm2
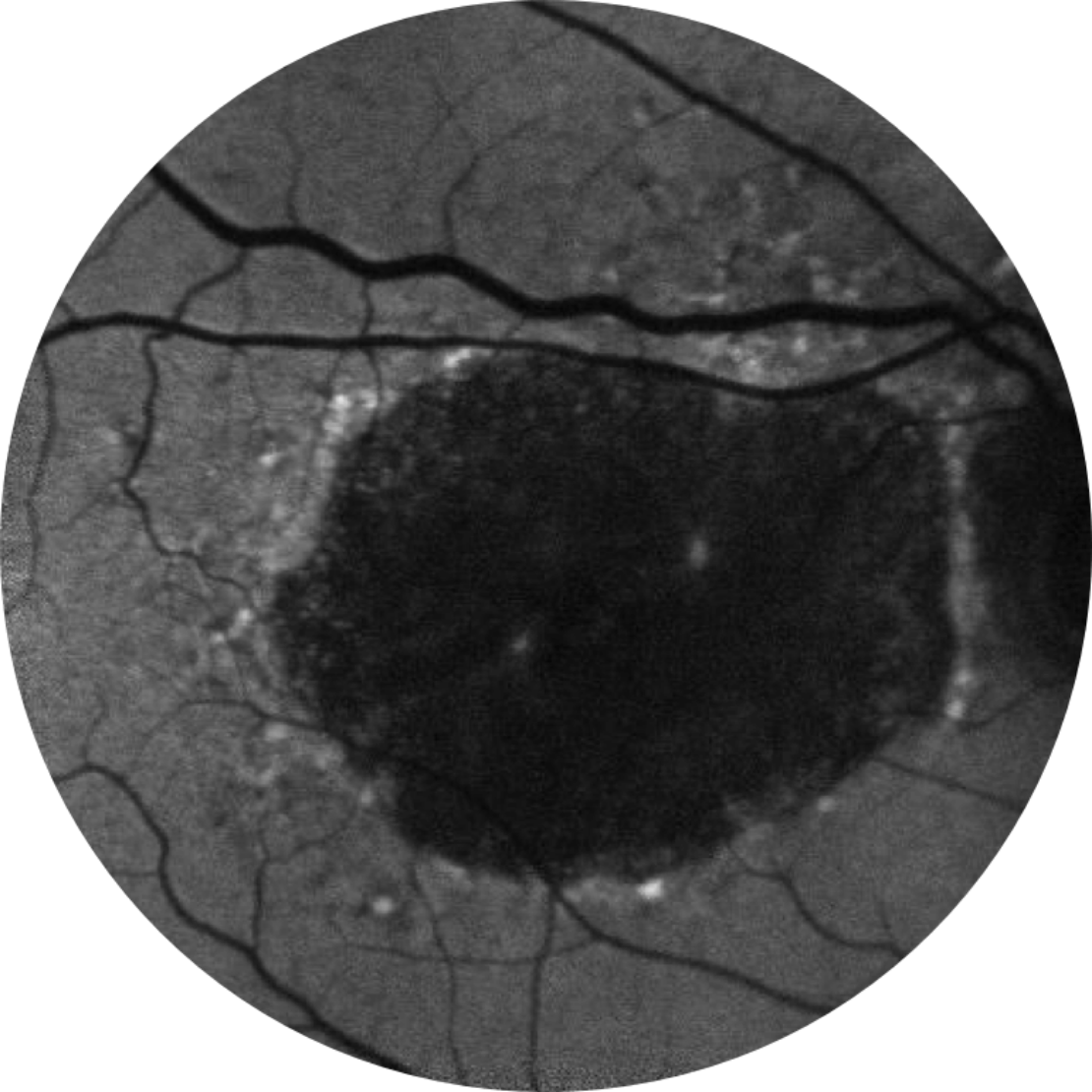
Baseline Jahr 5
BCVA 20/200, GA-Fläche 18,58 mm2
Das Läsionswachstum kann zu einer Verschlechterung der Sehkraft führen.2,16,17
Die Sehschärfe korreliert nicht stark mit dem Wachstum der Läsionen. Das funktionelle Sehvermögen nimmt mit dem Wachstum der Läsionen ab.15
BCVA = Bestkorrigierte Sehschärfe
Diagnose der Geographischen Atrophie
Bildgebungsverfahren der Netzhaut werden verwendet, um alle Stadien der altersabhängigen Makuladegeneration zu identifizieren, zu diagnostizieren und zu überwachen, einschließlich der Geographischen Atrophie.18
Bei der Diagnose und Überwachung der altersabhängigen Makuladegeneration sucht ein Augenarzt oder Netzhautspezialist nach den folgenden Merkmalen in der Netzhaut:19
• Drusen
• Ein scharf abgegrenzter Bereich in der Makularegion mit einer atrophischen Netzhaut ohne Pigmentierung
• Sichtbare Blutgefäße der Aderhaut
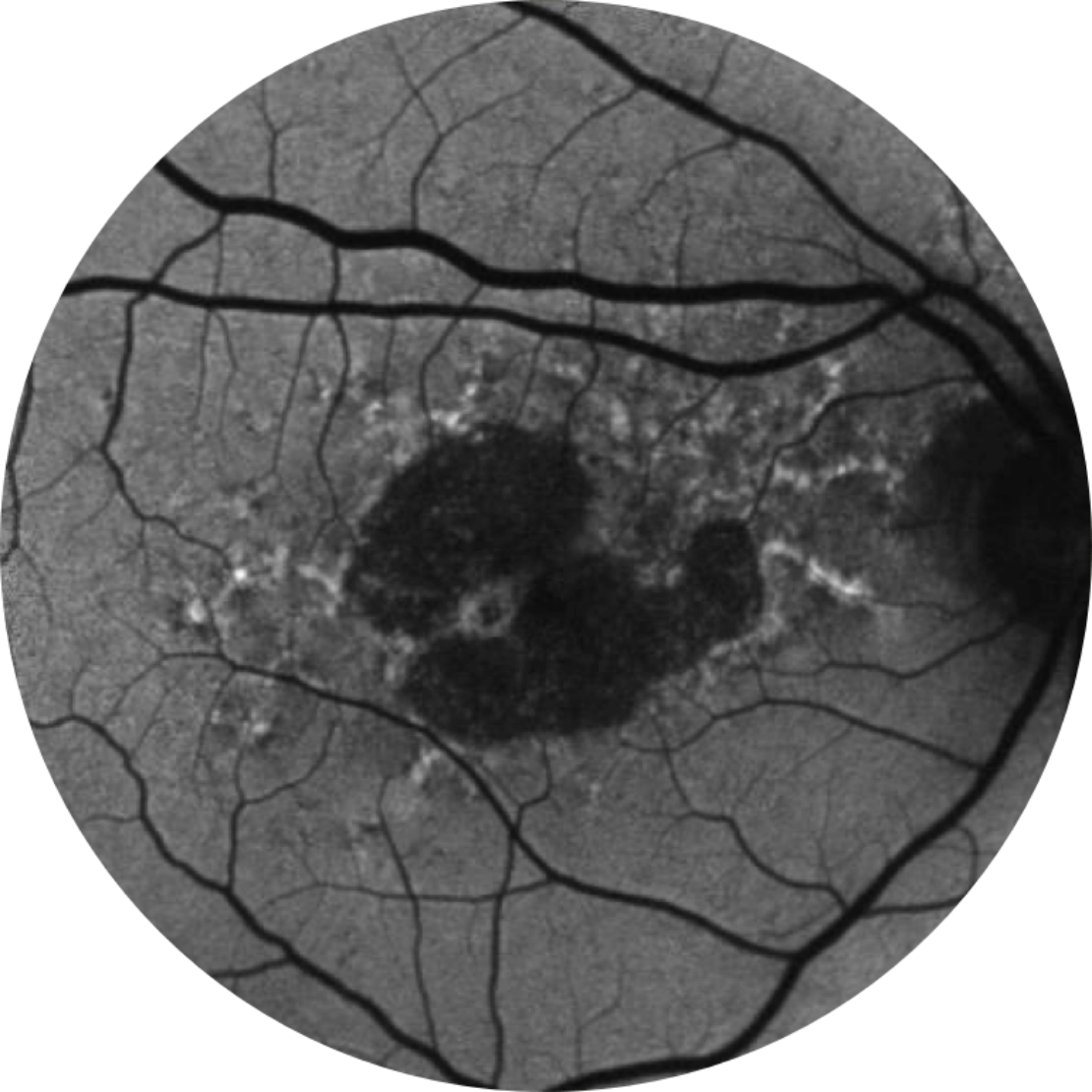
Normale Fundusautofluoreszenz einer Netzhaut
Die Fundus-Autofluoreszenz ist derzeit eine standardmäßige Bildgebungstechnologie zur Visualisierung des retinalen Pigmentepithels (RPE) bei Geographischer Atrophie.20
Horizontaler OCT-Scan über der Fovea
Optische Kohärenztomographie (Optical coherence tomography, OCT): Die Atrophie der Netzhautschichten ist mit diesem nicht-invasiven Bildgebungsverfahren deutlich zu erkennen.21
Aktuelle Behandlungsansätze
Konzentrieren sich auf die Bewältigung der Erkrankung, ohne das Wachstum der Läsionen zu verlangsamen oder zu stoppen.22-24

VISUELLE REHA25

SEHHILFEN26

AREDS NAHRUNGSERGÄN-ZUNGS-MITTEL27
EINSTELLEN DES RAUCHENS27

BEWEGUNG28

ERNÄHRUNG27
AREDS = Age-Related Eye Disease Study.
AREDS-Ergänzungsmittel sind keine zugelassene Therapie für GA.
Derzeit untersuchte therapeutische Ansätze
Bis heute gibt es keine zugelassenen Therapien, die die Progression der trockenen AMD im fortgeschrittenen Stadium verringern, obwohl mehrere potenzielle Therapien derzeit untersucht werden.11

Erforschung der Rolle der Komplementüberaktivierung bei Geographischer Atrophie
An der Pathogenese der Geographischen Atrophie könnten mehrere komplementvermittelte Signalwege beteiligt sein. Die Hemmung des Komplementwegs ist ein attraktives therapeutisches Ziel, um die Progression von GA zu verlangsamen.29,30
Melden Sie sich für unseren Newsletter zu geographischer Atrophie an
Gehören Sie zu den Ersten, die Neuigkeiten zu geografischer Atrophie erhalten
Vielen Dank dass Sie uns Ihre Daten gesendet haben.
Bitte schauen Sie in Ihre E-Mails, um Ihr Abonnement zu bestätigen.
Referenzen
- Fleckenstein, M. et al. (2018). The Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Ophthalmology, 125(3), 369–390. https://doi.org/10.1016/j.ophtha.2017.08.038.
- Boyer, D.S. et al. (2017). The pathophysiology of geographic atrophy secondary to age-related macular degeneration and the complement pathway as a therapeutic target. Retina, 37(5), pp.819–835. doi:10.1097/iae.0000000000001392.
- Lindblad, A.S. et al. (2009).Change in Area of Geographic Atrophy in the Age-Related Eye Disease Study. Archives of Ophthalmology, 127(9), p.1168. doi:10.1001/archophthalmol.2009.198.
- Holz, F.G. et al. (2014). Geographic atrophy: clinical features and potential therapeutic approaches. Ophthalmology, [online] 121(5), pp.1079–1091. doi:10.1016/j.ophtha.2013.11.023.
- Sunness, J.S et al. (2007). The long-term natural history of geographic atrophy from age-related macular degeneration: enlargement of atrophy and implications for interventional clinical trials. Ophthalmology, [online] 114(2), pp.271–277. doi:10.1016/j.ophtha.2006.09.016.
- Rudnicka, A.R. et al. (2012). Age and gender variations in age-related macular degeneration prevalence in populations of European ancestry: a meta-analysis. Ophthalmology, [online] 119(3), pp.571–580. doi:10.1016/j.ophtha.2011.09.027.
- Gehrs, K.M. et al. (2006). Age-related macular degeneration—emerging pathogenetic and therapeutic concepts. Annals of medicine, [online] 38(7), pp.450–471. doi:10.1080/07853890600946724.
- Biarnés, M. et al. (2011). Update on Geographic Atrophy in Age-Related Macular Degeneration. Optometry and Vision Science, 88(7), pp.881–889. doi:10.1097/opx.0b013e31821988c1.
- BrightFocus Foundation. (2018). Age-Related Macular Degeneration: Facts & Figures. [online] Verfügbar unter: https://www.brightfocus.org/macular/article/age-related-macular-facts-figures. Aufgerufen am 29. Apr. 2021.
- Rofagha, S. et al. (2013). Seven-Year Outcomes in Ranibizumab-Treated Patients in ANCHOR, MARINA, and HORIZON. Ophthalmology, 120(11), pp.2292–2299. doi:10.1016/j.ophtha.2013.03.046.
- Buschini, E. et al. (2015). Recent developments in the management of dry age-related macular degeneration. Clinical Ophthalmology, p.563. doi:10.2147/opth.s59724.
- Risk factors associated with age-related macular degeneration. (2000). Ophthalmology, 107(12), pp.2224–2232. doi:10.1016/s0161-6420(00)00409-7.
- Fritsche, L.G. et al. (2016). A large genome-wide association study of age-related macular degeneration highlights contributions of rare and common variants. Nature genetics, [online] 48(2), pp.134–143. doi:10.1038/ng.3448.
- Chong, E.W. et al. (2008). Alcohol Consumption and the Risk of Age-Related Macular Degeneration: A Systematic Review and Meta-Analysis. American Journal of Ophthalmology, [online] 145(4), pp.707-715.e2. doi:10.1016/j.ajo.2007.12.005.
- Heier, J.S. et al. (2020). Visual Function Decline Resulting from Geographic Atrophy: Results from the Chroma and Spectri Phase 3 Trials. Ophthalmology. Retina, [online] 4(7), pp.673–688. doi:10.1016/j.oret.2020.01.019.
- Kimel, M. et al. (2017). Functional Reading Independence (FRI) Index: A New Patient-Reported Outcome Measure for Patients With Geographic Atrophy. Investigative Opthalmology & Visual Science, 57(14), p.6298. doi:10.1167/iovs.16-20361.
- Sadda, S.R. Clinical endpoints for the study of geographic atrophy secondary to age-related macular degeneration. Retina, 36(10), pp.1806–1822. doi:10.1097/iae.0000000000001283.
- What is the difference between direct and indirect ophthalmoscopy (2016). What is the difference between direct and indirect ophthalmoscopy? [online] American Academy of Ophthalmology. Verfügbar unter: https://www.aao.org/eye-health/ask-ophthalmologist-q/what-is-difference-between-direct-indirect-ophthal. Aufgerufen am 20. Juli 2022.
- eyewiki.aao.org. (n.d.). Geographic Atrophy – EyeWiki. [online] Verfügbar unter: https://eyewiki.aao.org/Geographic_Atrophy. Aufgerufen am 20. Juli 2022.
- Townsend, W.D. (1992). Scleral depression. Optometry Clinics: The Official Publication of the Prentice Society, [online] 2(3), pp.127–144. Verfügbar unter: https://pubmed.ncbi.nlm.nih.gov/1463913.
- Ferguson, L.R. et al. (2014). Retinal Thickness Measurement Obtained with Spectral Domain Optical Coherence Tomography Assisted Optical Biopsy Accurately Correlates with Ex Vivo Histology. PLoS ONE, 9(10), p.e111203. doi:10.1371/journal.pone.0111203.
- Bandello, F. et al. (2017). Recent advances in the management of dry age-related macular degeneration: A review. F1000Research, 6, p.245. doi:10.12688/f1000research.10664.1.
- Chakravarthy, U. et al. (2018). Characterizing Disease Burden and Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Ophthalmology, 125(6), pp.842–849. doi:10.1016/j.ophtha.2017.11.036.
- Sacconi, R. et al. (2017). A Review of Current and Future Management of Geographic Atrophy. Ophthalmology and Therapy, [online] 6(1), pp.69–77. doi:10.1007/s40123-017-0086-6.
- Ramírez Estudillo, J.A. et al. (2017). Visual rehabilitation via microperimetry in patients with geographic atrophy: a pilot study. International Journal of Retina and Vitreous, [online] 3, p.21. doi:10.1186/s40942-017-0071-1.
- Gopalakrishnan, S. et al. (2020). Low-vision intervention in individuals with age-related macular degeneration. Indian Journal of Ophthalmology, [online] 68(5), pp.886–889. doi:10.4103/ijo.IJO_1093_19.
- Thorell, M.R. and Rosenfeld, P.J. (2014). Treatment of Geographic Atrophy: What’s on the Horizon? Current Ophthalmology Reports, 2(1), pp.20–25.
doi:10.1007/s40135-013-0036-y. - Seddon, J.M. (2003). Progression of Age-Related Macular Degeneration. Archives of Ophthalmology, 121(6), p.785. doi:10.1001/archopht.121.6.785.
- Katschke, K.J. et al. (2018). Classical and alternative complement activation on photoreceptor outer segments drives monocyte-dependent retinal atrophy. Scientific Reports, [online] 8(1), p.7348. doi:10.1038/s41598-018-25557-8.
- Heesterbeek, T.J. et al. (2020). Complement Activation Levels Are Related to Disease Stage in AMD. Investigative Ophthalmology & Visual Science, [online] 61(3), pp.18–18. doi:10.1167/iovs.61.3.18.
EU-GA-2200013