Progression de l’atrophie géographique
Les régions d’atrophie commencent généralement hors de la fovéa et s’étendent à cette dernière, entraînant au fil du temps une perte de vision irréversible.1
Actuellement, l’atrophie géographique touche plus de 5 millions de personnes dans le monde. Ce nombre devrait dépasser 18 millions d’ici 2040.1
À partir de 50 ans, la prévalence
quadruple tous les 10 ans.6
L’atrophie géographique
cause jusqu’à 20 % des cécités légales attribuées à la DMLA.7,8
Un œil atteint d’atrophie géographique peut aussi développer une DMLA humide et vice versa.9
des patients atteints de DMLA humide ont évolué vers une atrophie géographique sur un suivi moyen de 7,3 ans.10
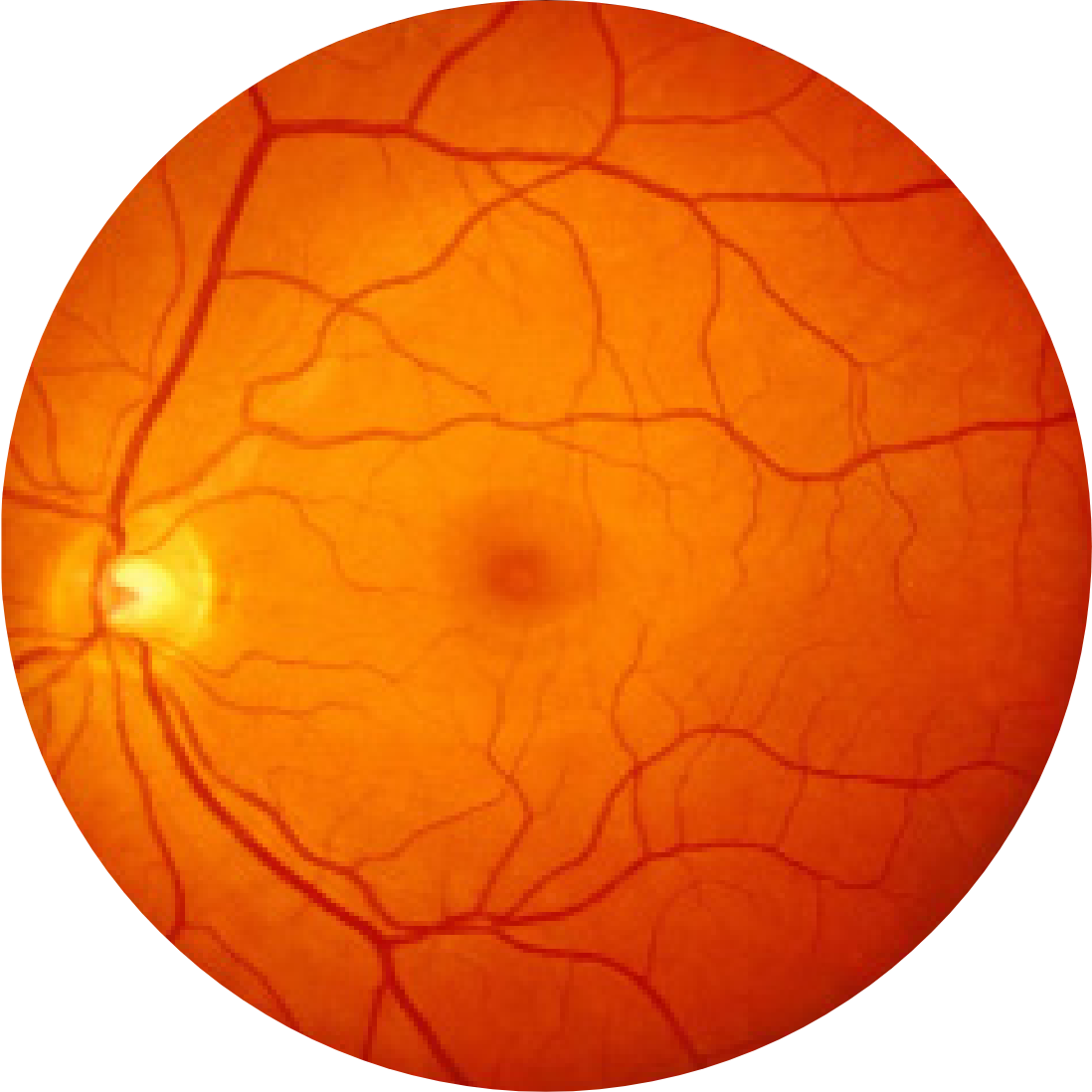
Photographie du fond d’un œil sain
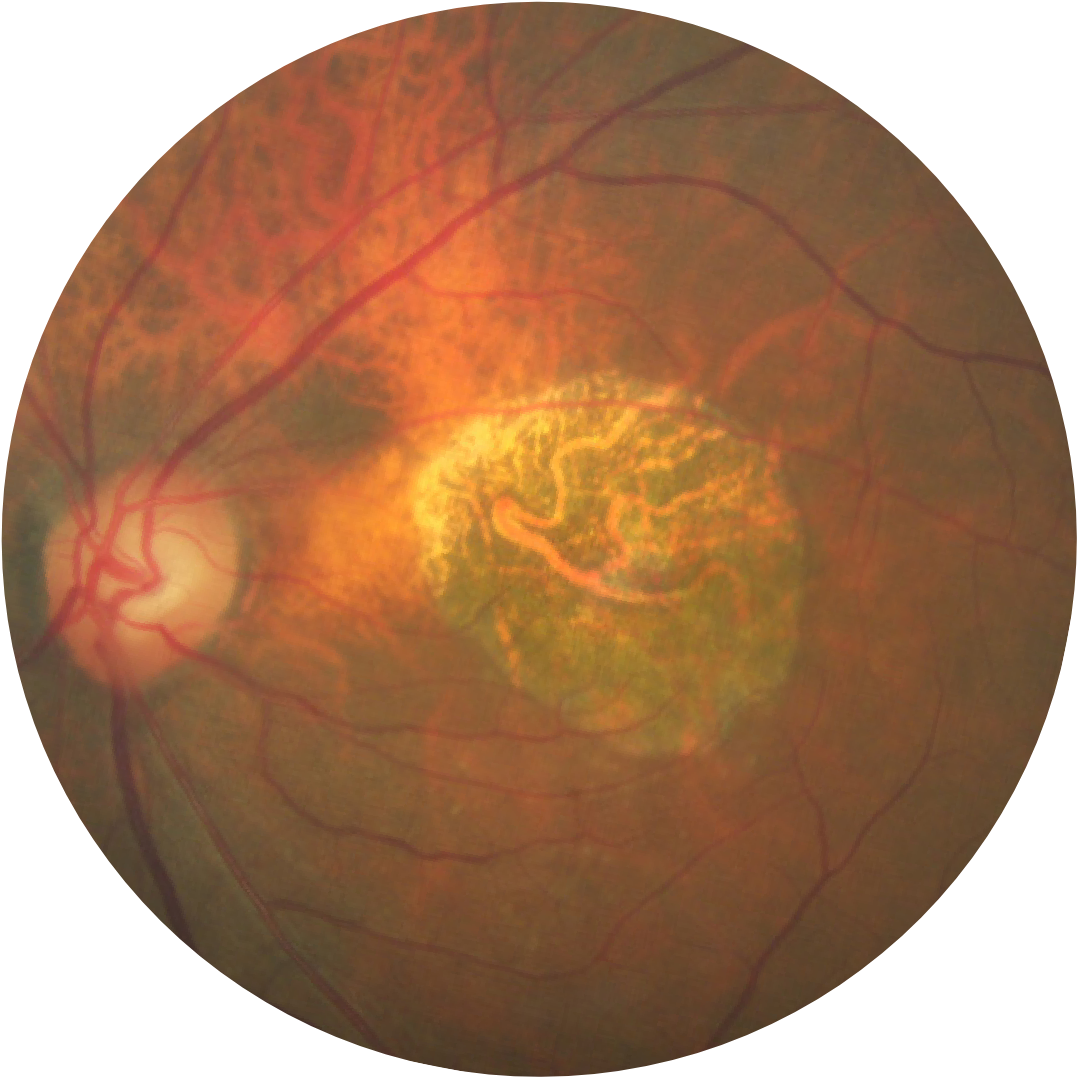
Photographie du fond d’un œil atteint d’atrophie géographique
L’atrophie géographique se caractérise par une perte progressive et irréversible des photorécepteurs, de l’épithélium pigmentaire rétinien (EPR) et de la choriocapillaire sous-jacente.1,2
Les régions d’atrophie commencent généralement hors de la fovéa et s’étendent à cette dernière, entraînant au fil du temps une perte de vision irréversible.1
Causes de l’atrophie géographique
La dégénérescence maculaire liée à l’âge est une maladie multifactorielle complexe ; la pathogenèse de l’atrophie géographique englobe une interaction complexe de facteurs génétiques, physiologiques et environnementaux.11-14
Génétique
- Formation de drusens
- Formation de dérivés réactifs de l’oxygène
- Inflammation
- Réponse immunitaire, système du complément inclus
Physiologie
- L’âge est le principal facteur de risque d’atrophie géographique
- Certains types de dyslipidémies
Environnement
- Lumière du soleil, tabagisme et alimentation
- Consommation élevée d’alcool
Référence Année 1
MAVC 20/63+, région AG 5,18 mm2
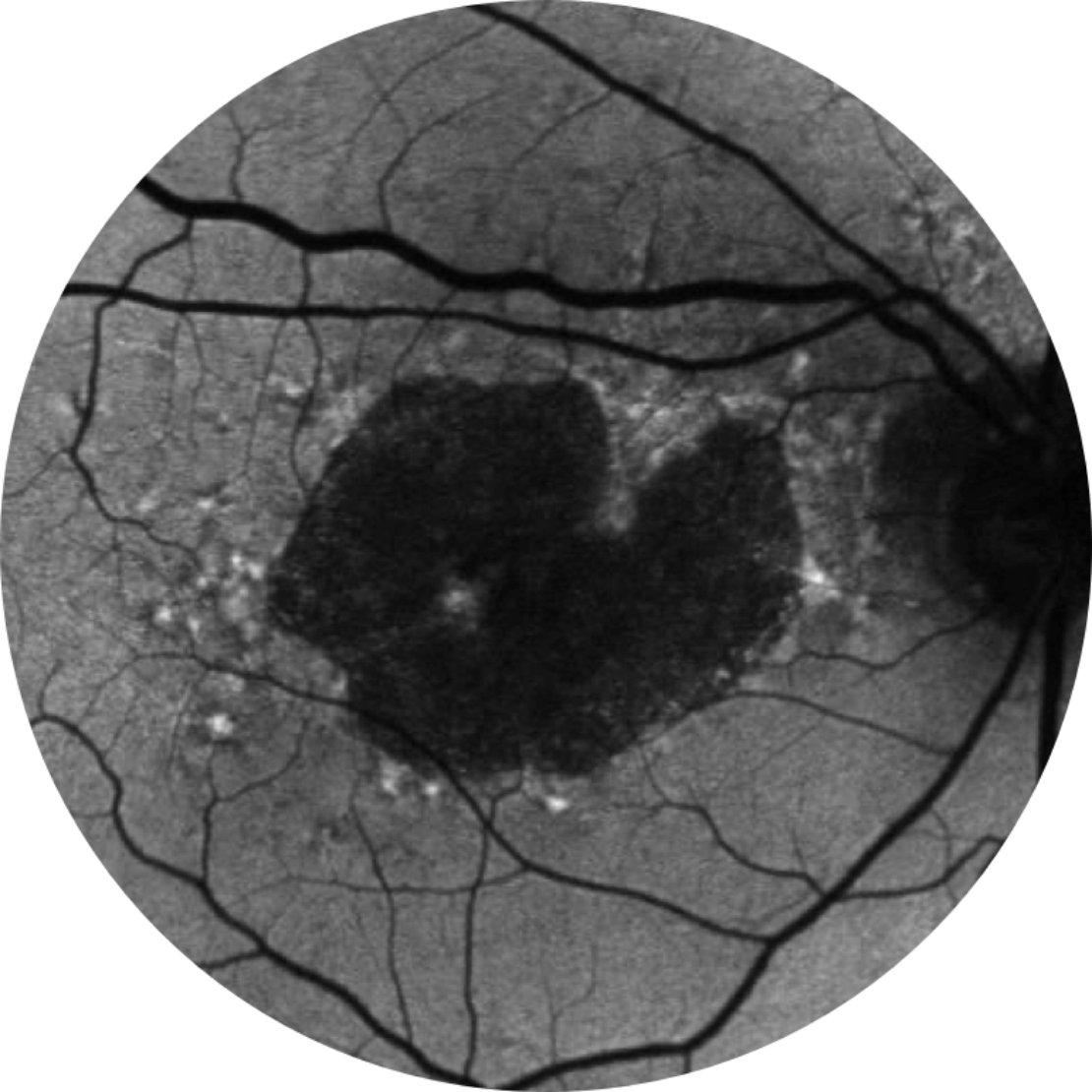
Référence Année 2
MAVC 20/80-2, région AG 10,39 mm2
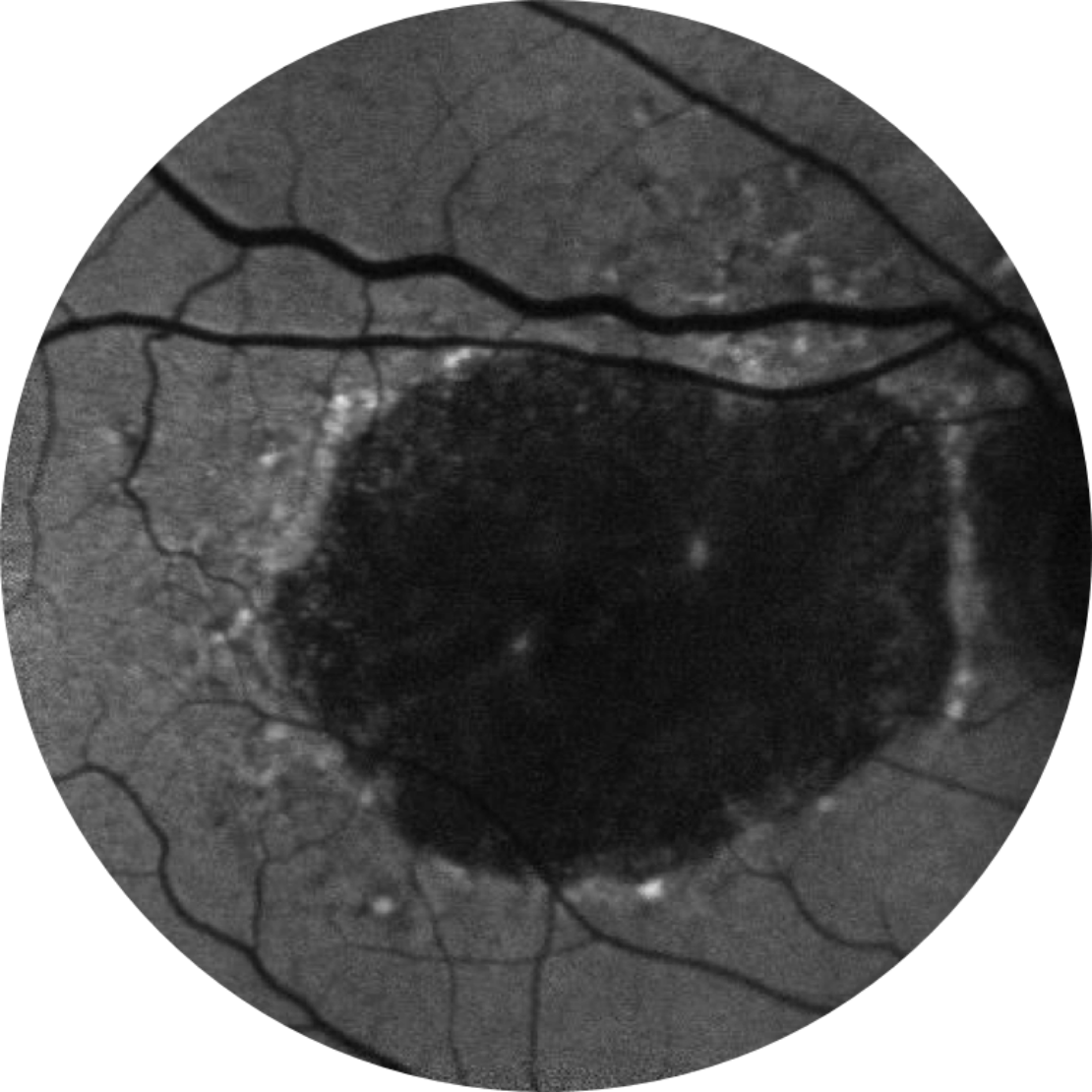
Référence Année 5
MAVC 20/200, région AG 18,58 mm2
La croissance des lésions peut entraîner un déclin visuel.2,16,17
L’acuité visuelle n’est pas fortement corrélée à la croissance des lésions d’atrophie géographique. La vision fonctionnelle décline à mesure que les lésions grossissent.15
MAVC = meilleure acuité visuelle corrigée
Diagnostic de l’atrophie géographique
Les techniques d’imagerie rétinienne sont utilisées pour identifier, diagnostiquer et surveiller tous les stades de la dégénérescence maculaire liée à l’âge, y compris l’atrophie géographique.18
Lors du diagnostic et de la surveillance de la dégénérescence maculaire liée à l’âge, un ophtalmologue, un spécialiste de la rétine recherchera les caractéristiques suivantes dans la rétine :19
• présence de drusens
• région nettement délimitée dans la région maculaire avec une rétine atrophique, sans pigmentation
• vaisseaux sanguins choroïdiens sous-jacents visibles
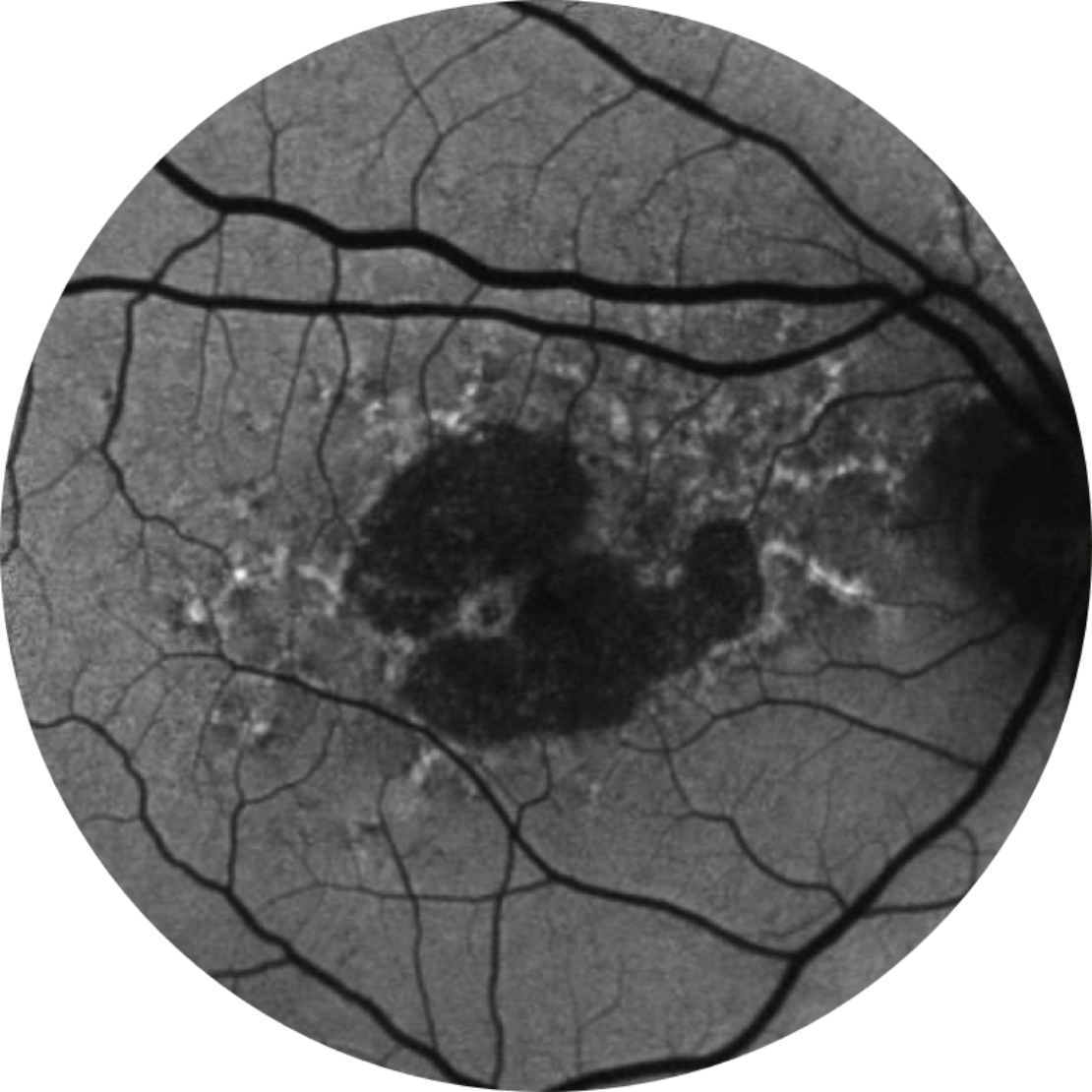
Autofluorescence du fond d’œil d’une rétine saine
L’angiographie par autofluorescence du fond de l’œil est actuellement une technologie d’imagerie standard permettant de visualiser l’épithélium pigmentaire rétinien (EPR) dans l’atrophie géographique.20
TCO horizontale sur la fovéa
Tomographie par cohérence optique (TCO) : l’atrophie des couches rétiniennes s’observe clairement avec cette technique d’imagerie non invasive.21
Méthodes actuelles de prise en charge
Se concentrer sur la vie avec la maladie, sans ralentir ou arrêter la croissance des lésions.22-24

RÉADAPTATION VISUELLE25

AIDES BASSE VISION26

COMPLEMENTS AREDS27
SEVRAGE TABAGIQUE27

ACTIVITÉ PHYSIQUE28

ALIMENTATION27
AREDS = Age-Related Eye Disease Study (étude sur les maladies oculaires liées à l’âge).
Les suppléments AREDS ne sont pas un traitement approuvé pour l’AG.
Approches thérapeutiques en cours d’investigation
À ce jour, il n’existe aucun traitement approuvé pour freiner la progression de la DMLA sèche avancée, bien que plusieurs traitements potentiels soient à l’étude.11

Explorer le rôle de la suractivation du complément dans l’atrophie géographique
La pathogenèse de l’atrophie géographique implique possiblement plusieurs voies de signalisation associées au complément. L’inhibition de la voie de signalisation du complément est une cible thérapeutique attractive pour ralentir la progression de l’AG.29,30
Rejoignez notre exploration de l’atrophie géographique
Soyez le premier/la première à recevoir les dernières nouvelles concernant l’atrophie géographique
Merci d’avoir soumis vos coordonnées.
Veuillez vérifier vos e-mails afin de confirmer votre abonnement.
Références
- Fleckenstein, M. et al. (2018). The Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Ophthalmology, 125(3), 369–390. https://doi.org/10.1016/j.ophtha.2017.08.038.
- Boyer, D.S. et al. (2017). The pathophysiology of geographic atrophy secondary to age-related macular degeneration and the complement pathway as a therapeutic target. Retina, 37(5), pp.819–835. doi:10.1097/iae.0000000000001392.
- Lindblad, A.S. et al. (2009).Change in Area of Geographic Atrophy in the Age-Related Eye Disease Study. Archives of Ophthalmology, 127(9), p.1168. doi:10.1001/archophthalmol.2009.198.
- Holz, F.G. et al. (2014). Geographic atrophy: clinical features and potential therapeutic approaches. Ophthalmology, [en ligne] 121(5), pp.1079–1091. doi:10.1016/j.ophtha.2013.11.023.
- Sunness, J.S et al. (2007). The long-term natural history of geographic atrophy from age-related macular degeneration: enlargement of atrophy and implications for interventional clinical trials. Ophthalmology, [en ligne] 114(2), pp.271–277. doi:10.1016/j.ophtha.2006.09.016.
- Rudnicka, A.R. et al. (2012). Age and gender variations in age-related macular degeneration prevalence in populations of European ancestry: a meta-analysis. Ophthalmology, [en ligne] 119(3), pp.571–580. doi:10.1016/j.ophtha.2011.09.027.
- Gehrs, K.M. et al. (2006). Age-related macular degeneration—emerging pathogenetic and therapeutic concepts. Annals of medicine, [en ligne] 38(7), pp.450–471. doi:10.1080/07853890600946724.
- Biarnés, M. et al. (2011). Update on Geographic Atrophy in Age-Related Macular Degeneration. Optometry and Vision Science, 88(7), pp.881–889. doi:10.1097/opx.0b013e31821988c1.
- BrightFocus Foundation. (2018). Age-Related Macular Degeneration: Facts & Figures. [en ligne] Disponible à l’adresse : https://www.brightfocus.org/macular/article/age-related-macular-facts-figures. Accès le 29 avril 2021.
- Rofagha, S. et al. (2013). Seven-Year Outcomes in Ranibizumab-Treated Patients in ANCHOR, MARINA, and HORIZON. Ophthalmology, 120(11), pp.2292–2299. doi:10.1016/j.ophtha.2013.03.046.
- Buschini, E. et al. (2015). Recent developments in the management of dry age-related macular degeneration. Clinical Ophthalmology, p.563. doi:10.2147/opth.s59724.
- Risk factors associated with age-related macular degeneration. (2000). Ophthalmology, 107(12), pp.2224–2232. doi:10.1016/s0161-6420(00)00409-7.
- Fritsche, L.G. et al. (2016). A large genome-wide association study of age-related macular degeneration highlights contributions of rare and common variants. Nature genetics, [en ligne] 48(2), pp.134–143. doi:10.1038/ng.3448.
- Chong, E.W. et al. (2008). Alcohol Consumption and the Risk of Age-Related Macular Degeneration: A Systematic Review and Meta-Analysis. American Journal of Ophthalmology, [en ligne] 145(4), pp.707-715.e2. doi:10.1016/j.ajo.2007.12.005.
- Heier, J.S. et al. (2020). Visual Function Decline Resulting from Geographic Atrophy: Results from the Chroma and Spectri Phase 3 Trials. Ophthalmology. Retina, [en ligne] 4(7), pp.673–688. doi:10.1016/j.oret.2020.01.019.
- Kimel, M. et al. (2017). Functional Reading Independence (FRI) Index: A New Patient-Reported Outcome Measure for Patients With Geographic Atrophy. Investigative Opthalmology & Visual Science, 57(14), p.6298. doi:10.1167/iovs.16-20361.
- Sadda, S.R. Clinical endpoints for the study of geographic atrophy secondary to age-related macular degeneration. Retina, 36(10), pp.1806–1822. doi:10.1097/iae.0000000000001283.
- What is the difference between direct and indirect ophthalmoscopy (2016). What is the difference between direct and indirect ophthalmoscopy? [en ligne] American Academy of Ophthalmology. Disponible à l’adresse: https://www.aao.org/eye-health/ask-ophthalmologist-q/what-is-difference-between-direct-indirect-ophthal. Accès le 20 juillet 2022.
- eyewiki.aao.org. (n.d.). Geographic Atrophy – EyeWiki. [en ligne] Disponible à l’adresse : https://eyewiki.aao.org/Geographic_Atrophy. Accès le 20 juillet 2022.
- Townsend, W.D. (1992). Scleral depression. Optometry Clinics: The Official Publication of the Prentice Society, [en ligne] 2(3), pp.127–144. Disponible à l’adresse : https://pubmed.ncbi.nlm.nih.gov/1463913.
- Ferguson, L.R. et al. (2014). Retinal Thickness Measurement Obtained with Spectral Domain Optical Coherence Tomography Assisted Optical Biopsy Accurately Correlates with Ex Vivo Histology. PLoS ONE, 9(10), p.e111203. doi:10.1371/journal.pone.0111203.
- Bandello, F. et al. (2017). Recent advances in the management of dry age-related macular degeneration: A review. F1000Research, 6, p.245. doi:10.12688/f1000research.10664.1.
- Chakravarthy, U. et al. (2018). Characterizing Disease Burden and Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Ophthalmology, 125(6), pp.842–849. doi:10.1016/j.ophtha.2017.11.036.
- Sacconi, R. et al. (2017). A Review of Current and Future Management of Geographic Atrophy. Ophthalmology and Therapy, [en ligne] 6(1), pp.69–77. doi:10.1007/s40123-017-0086-6.
- Ramírez Estudillo, J.A. et al. (2017). Visual rehabilitation via microperimetry in patients with geographic atrophy: a pilot study. International Journal of Retina and Vitreous, [en ligne] 3, p.21. doi:10.1186/s40942-017-0071-1.
- Gopalakrishnan, S. et al. (2020). Low-vision intervention in individuals with age-related macular degeneration. Indian Journal of Ophthalmology, [en ligne] 68(5), pp.886–889. doi:10.4103/ijo.IJO_1093_19.
- Thorell, M.R. and Rosenfeld, P.J. (2014). Treatment of Geographic Atrophy: What’s on the Horizon? Current Ophthalmology Reports, 2(1), pp.20–25.
doi:10.1007/s40135-013-0036-y. - Seddon, J.M. (2003). Progression of Age-Related Macular Degeneration. Archives of Ophthalmology, 121(6), p.785. doi:10.1001/archopht.121.6.785.
- Katschke, K.J. et al. (2018). Classical and alternative complement activation on photoreceptor outer segments drives monocyte-dependent retinal atrophy. Scientific Reports, [en ligne] 8(1), p.7348. doi:10.1038/s41598-018-25557-8.
- Heesterbeek, T.J. et al. (2020). Complement Activation Levels Are Related to Disease Stage in AMD. Investigative Ophthalmology & Visual Science, [en ligne] 61(3), pp.18–18. doi:10.1167/iovs.61.3.18.
EU-GA-2200013